Большая Советская
Энциклопедия
|
|
|
|
источник статьи: Большая Советская Энциклопедия |
|
Упаковки плотнейшие в кристаллографии, формы расположения атомов в кристаллической решётке, которые характеризуются наибольшим числом атомов в единице объёма кристалла. У. п. отчётливо выражены в большом числе кристаллических структур. Они характерны для большинства металлов, а также для кристаллизованных инертных газов. Структуры многих неорганических (ионных) кристаллов представляют собой У. п. шаровых анионов (с большими ионными радиусами), в пустотах которых распределяются мелкие катионы. Более 300 лет известна (И. Кеплер) и признаётся наиболее плотной упаковка шаров «вручную» (рис. 1), когда на слой шаров, уложенных с квадратным мотивом, наложен другой такой же слой шаров в лунки нижележащего (коэффициент заполнения пространства 74,05%, рис. 2). Очевидно, что шары третьего слоя будут лежать точно над шарами первого. Такая уп аковка обычно называется кубической плотнейшей гранецентрированной. Она считалась единственной, пока в 1900 англ. кристаллограф У. Барлоу не показал, что, поставив куб на угол, его можно разобрать на плоские ещё более плотные слои (рис. 3), в которых лунок между шарами в два раза больше числа самих шаров (рис. 4). Варьируя укладку плотноупакованных слоев (рис. 5), получают бесчисленное множество плотнейщих упаковок с одинаковым коэффициентом заполнения – 74,05%. Если ограничить наслаивание некоторым периодом, то получается: двухслойная плотнейшая упаковка (рис. 6, а, третий слой повторяет первый), трёхслойная (рис. 6, б, четвёртый слой повторяет первый), четырёхслойная (рис. 6, в) и т.д. Трёхслойная упаковка – это исходная кубическая, прочие – все гексагональные. Благородные металлы Ag, Au, Pt, a также Cu, Al, Pb,g-Fe характеризуются трёхслойной – кубической п лотнейшей упаковкой атомов. Двухслойной упаковке подчиняются Be, Mg, Zn, Ti, четырёхслойной – редкоземельные металлы: La, Ce и др. Весьма часто полиморфизм (уже не только чистых металлов, но и соединений с простейшей формулой АХ) сводится к смене типа плотнейшей упаковки 6-, 8-, 15-слойными вплоть до числа слоев в несколько десятков (карборунд SiC). Кристаллические решётки некоторых соединений характеризуются менее плотной объёмноцентрированной укладкой (рис. 7) с коэффициентов заполнения 68% (a-железо, щелочные металлы). Поскольку наиболее распространены двух- и трёхслойные упаковки со стандартным расположением анионных шаров, то структура химического соединения зачастую определяется распределением др. элементов структуры, главным образом катионов, по пустотам плотнейшей упаковки (см. Структуры кристаллов). Их 2 сор та: среди 6 шаров (октаэдрической пустоты) и среди 4 шаров (тетраэдрические пустоты); вторых в 2 раза больше, чем первых (как показано на рис. 8 – с анионами в вершинах плотноупакованных полиэдров). При описании структур ограничиваются обычно выделением в таких слоях заполненных полиэдров, которые раскрашивают в разные цвета соответственно сортности заселяющих атомов (рис. 9).
Лит.: Белов Н. В., Структура ионных кристаллов и металлических фаз, М., 1947. Н. В. Белов.
 Рис. 7. Объёмноцентрированная упаковка. 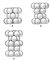 Рис. 6. Плотнейшие шаровые упаковки: а — двухслойная, б — трёхслойная, в — четырёхслойная.  Рис. 2. Генерирующие плотнейшую кубическую упаковку плоские слои с квадратной симметрией.  Рис. 4. Плотнейшая гексагональная упаковка.  Рис. 3. Генерирующие плотнейшую упаковку плоские слои с гексагональной симметрией.  Рис. 8. Слой из плотноупакованных октаэдров и тетраэдров в отношении 1:2.  Рис. 1. Плотнейшая кубическ ая упаковка. Элементарная ячейка.  Рис. 9. Раскраска заселённых тетраэдров плотноупакованной структуры станнина Cu2FeSnS4 в три цвета.  Рис. 5. Плоский плотноупакованный слой с числом лунок в два раза большим числа шаров. |