Большая Советская Энциклопедия
(БСЭ)
|
|
|
|
источник статьи: Большая Советская Энциклопедия (БСЭ) |
|
Лизоцим (от греч. lýsis — растворение, распад и zýme — закваска), мурамидаза, фермент класса гидролаз; разрушает стенку бактериальной клетки, в результате чего происходит её растворение (лизис). В организме играет роль неспецифического антибактериального барьера, особенно в местах контакта с внешней средой (слёзы, слюна, слизистая оболочка носа). Л. открыт в 1922 А. Флемингом в слизи из полости носа и затем обнаружен во многих тканях и жидкостях человеческого организма (хрящи, селезёнка, лейкоциты, слёзы), в растениях (капуста, репа, редька, хрен), в некоторых бактериях и фагах и, в наибольшем количестве, в яичном белке. Л. из разных источников различаются по строению, но близки по действию. Л. яичного белка — первый фермент, для которого методом рентгеноструктурного анализа установлена трёхмерная структура и выявлена связь между строением и механизмом действия (1965); эти исследования — существенный вклад в представления о механизмах ферментативного катализа в целом. Л. — белок с молекулярной массой около 14 000; единственная полипептидная цепь состоит из 129 аминокислотных остатков и свёрнута в компактную глобулу (30´30´45 Препарат Л. применяют при лечении глаз, носоглотки, дёсен, ожогах, в акушерстве и др.
Лит.: Филлипс Д., Трехмерная структура молекулы фермента, в сборнике: Молекулы и клетки, пер. с англ., в. 3, М., 1968; Химия белка, М., 1969; Бернхард С., Структура и функция ферментов, пер. с англ., М., 1971. Н. А. Кравченко. 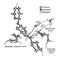 Механизм гидролиза полисахарида лизоцимом. Показаны 3 из 6 колец, помещающихся в щели фермента. Гликозидная связь между кольцами 4 и 5 активируется взаимодействием между остатками аспарагиновой (А) и глутаминовой (Г) кислот главной цепи лнзоцима и атомами углерода кольца 4 и кислорода, связывающего кольца 4 и 5. После разрыва связи две части молекулы субстрата освобождаются, и фермент получает возможность расщеплять следующий участок полисахаридной цепи. |