Большая Советская Энциклопедия
(БСЭ)
|
|
|
|
источник статьи: Большая Советская Энциклопедия (БСЭ) |
|
Геохимия (от гео… и химия), наука о химическом составе Земли, законах распространённости и распределения в ней химических элементов, способах сочетания и миграции атомов в ходе природных процессов. Г. — часть космохимии. Единицами сравнения в Г. являются атомы и ионы. Одна из важнейших задач Г. — изучение на основе распространённости химических элементов химической эволюции Земли, стремление объяснить на химической основе происхождение и историю Земли, дифференциацию её на оболочки (геосферы). Наибольшее внимание в Г. уделяется проблемам распространённости и распределения химических элементов. Распространённость химических элементов. Распространённость различных химических элементов определяется синтезом их ядер, происходящим по разным термоядерным реакциям в недрах звёзд. Стадия эволюции звезды (её температура) определяет характер этого синтеза. Согласно наиболее распространённым космогоническим гипотезам (см. Космогония), при образовании Солнца из сжимающейся и вращающейся туманности на заключительной стадии сжатия от центрального сгущения отделилась значительная масса горячей плазмы, которая образовала вокруг него протопланетное облако в виде диска. Облако быстро охлаждалось, и в нём возникла спонтанная конденсация вещества. В результате многостадийных реакций (конденсационный рост ядер, их коагуляция, процессы аккреции и агломерации) газовое облако превратилось в газопылевое. Одновременно происходила потеря облаком газов в космическое пространство. Холодное газопылевое облако в силу ротационной неустойчивости разбилось на ряд сгущений — протопланет, которые адиабатически сжимались. Благодаря этому процессу из холодного вещества протопланетного облака образовались планеты земного типа и астероидный пояс с астероидами и метеоритами. Наконец, на периферии протопланетного облака происходила при очень низких абсолютных температурах конденсация отлетевших газов (Н, Не, NH3, CH4 и др.), образовавших большие планеты — Юпитер, Сатурн, Нептун, Уран. Непосредственное определение общего состава планеты невозможно, однако астрономические (спектральные) данные о составе Солнца и данные о химическом составе каменных метеоритов (наиболее распространённых — хондритов) позволяют судить о распространенности химических элементов на Земле и на др. планетах. Из табл. 1 видно, что распространенность элементов на Солнце и в метеоритах совпадают.
Табл. 1. — Распространенность химических элементов на Солнце и в каменных метеоритах (хондритах) (SMg — число атомов данного элемента на 106 атомов магния).
Наиболее распространённые элементы (изотопы) имеют четные по протонам и четные по нейтронам ядра: и многие др. Элементы с чётно-нечётным числом протонов или нейтронов занимают среднее место. Элементы с нечётным числом протонов и нейтронов имеют очень малую распространённость, например Распространенность элементов с четными порядковыми номерами больше соседних с нечетными номерами (рис. 1). Лёгкие элементы Li, Be, B находятся в дефиците, т. к. «горают» в реакциях с протонами. Ядра элементов конца Менделеевской системы имеют огромный избыток нейтронов и потому неустойчивы. Эти элементы претерпевают радиоактивный распад (U, Th, Ra и др.) и спонтанное деление (U, Th, некоторые актиниды). Из данных о химическом составе оболочек Земли следует, что Земля имеет метеоритный состав. Метеориты разделяются на каменные (хондриты и более редкие ахондриты), железные (из Fe — Ni сплава) и смешанные. Хондриты потеряли все летучие вещества, кроме тех, которые прочно вошли в соединение с твёрдым веществом метеоритов — H2O, FeS, С, NH3 и др. Т. о., их твёрдое вещество по распространённости элементов отвечает солнечному составу; Mg, Si, Fe, О занимают первые места (по числу атомов Si/Mg = 1), затем S, Al, Са и др. Силикатная фаза хондритов состоит преимущественно из мета- и ортосиликатов (см. Силикаты) — пироксенов (MgSiO3) и оливинов [(Mg, Fe)2SiO4], т. е. является тройной системой MgO, SiO2, FeO. Каменные метеориты — многофазные системы; помимо главных фаз — силикатной и металлической (сплав Fe — Ni), они имеют ещё сульфидную, хромитную, карбидную, фосфидную фазы. Отношение силикатной и металлической фаз в разных метеоритах варьирует. Многие учёные, исходя из аналогии с метеоритами, считают, что планеты земного типа имеют также силикатную фазу и металлическое ядро, причём отношения между этими фазами у разных планет различны. По этой гипотезе, Земля имеет около 31% металлической фазы, или около 40% Fe (включая окисленное). Распределение химических элементов. Земля, как и др. планеты земного типа и Луна, имеет оболочечное строение; она состоит из ряда геосфер: ядра, мантии, земной коры, гидросферы и атмосферы (см. Земля). Твёрдые оболочки Земли, слагающие их горные породы, парагенетические ассоциации минералов и т. п., как правило, — сложные многокомпонентные силикатные системы. Процессы, при которых они образуются, идут с конечными скоростями и являются необратимыми. В Г. мы встречаемся с неравновесными системами, которые характеризуются массой, объёмом, энтропией, давлением, температурой, химическими потенциалами. Для применения термодинамики в Г. необходимо знать поведение конкретных фаз, компонентов и систем в условиях геологической обстановки, в частности в большом диапазоне давлений и температур. Так, например, общее представление о направлении геохимического процесса даёт Ле Шателье — Брауна принцип, согласно которому в любой системе, находящейся под действием внешних сил, изменение какого-либо внешнего фактора вызывает превращение, направленное на компенсацию действия этого фактора. По действующих масс закону изменение активности одного из компонентов системы смещает равновесие. Например, в реакции равновесие смещается вправо, т. к. ангидрит выпадает из раствора. В реакции начинающейся при температуре выше 350 °С, равновесие сдвигается вправо, т. к. одновременно с отложением минерала волластонита CaCO3 образуется углекислота, удаляющаяся из системы. С повышением температуры в реакциях с участием газовой фазы равновесие смещается в сторону меньшего объёма газовых компонентов. Например, в реакции равновесие сдвигается вправо. Высокое давление (газовое и литостатическое) изменяет направление и характер кристаллизации магмы. Условия равновесия подчиняются также правилу фаз Гиббса (см. Фаз правило), согласно которому число термодинамических степеней свободы системы f = k — n + 2, где n — число фаз в системе, k — число компонентов. Поскольку в закрытой системе число степеней свободы f £ 2 (давление и температура), то число фаз n ³ k. Это минералогическое правило фаз, впервые в Г. примененное В. М. Гольдшмидтом, оправдывается для разнообразных горных пород. Закономерности распределения отдельных элементов по многочисленным фазам — минералам зависят главным образом от строения внешних электронных оболочек атомов. В Г. поэтому широко используются закономерности, установленные кристаллохимией. Ионы и атомы в кристаллических решётках имеют разные радиусы Ri. Величина Ri связана с положением химичекого элемента в системе Менделеева. По вертикальным группам Ri обычно растет с увеличением атомной массы и уменьшается с увеличением валентности иона в пределах периода (см. табл. 2; цифры со стрелками обозначают поля элементов (оконтурены жирной линией): 1 — литофильных; 2 — халькофильных; 3 — сидерофильных. Для каждого элемента приведены значения атомного радиуса (0) и ионных радиусов при различных валентностях и координационных числах (обозначены римскими цифрами). Звёздочка обозначает пара- или ферромагнитное состояние переходных элементов; отсутствие звёздочки — диамагнитное состояние. Атомные радиусы даны по Дж. Слейтеру, ионные — по P. Д. Шеннону и К. Г. Превитту, ионные (в скобках) — по Л. Аренсу). В природных процессах разделения ионы и атомы сортируются по своим размерам. Кристаллические решётки главных породообразующих минералов принимают одни ионы (или атомы) и не принимают другие, в зависимости от их величины, заряда и др. свойств. Если ионы разновалентны, но имеют близкий размер Ri, в решётку чаще всего входит ион с большим зарядом. Если ионы имеют одинаковую валентность и по размеру различаются не больше чем на 15%, они часто изоморфно замещаются в кристаллических решётках; происходит замещение атома атомом, иона ионом или группы атомов группой атомов, в зависимости от типа решётки, размеров Ri, заряда и т. д. (см. Изоморфизм). Изоморфное замещение играет огромную роль в распределении элементов по различным минералам. Использование Ri в Г. объяснило причину ассоциации таких разнородных элементов, как U, Th и редкоземельных элементов (в минералах торианит, иттриалит и др.), а также постоянную ассоциацию редкоземельных элементов. При деформации одного иона другим в соединении, имеющем катион малого радиуса и анион большого радиуса, возникает т. н. поляризация, которая нарушает физико-химические свойства вещества — твёрдость, летучесть и многие др. Отношение Ri катиона/ Ri аниона определяет число атомов, окружающих центральный атом в соединении, — его координацию, т. е. координационное число. Оно в свою очередь указывает на характер и строение кристаллической решётки. Координационное число может изменяться в зависимости от условий образования минерала. Кристаллические решётки минералов имеют различную структуру — от очень простых и симметричных построек из плотно упакованных шаров до весьма сложных с низкой степенью симметрии. При кристаллизации атомы и ионы стремятся расположиться в кристаллической решётке таким образом, чтобы была минимальной энергия кристаллической решётки. На основе всех этих данных была создана геохимическая классификация элементов, опирающаяся на физико-химические свойства химических элементов (табл. 3).
Табл. 3. — Геохимическая классификация химических элементов
С открытием изотопов стала развиваться Г. изотопов — изучение процессов разделения изотопов химических элементов в природных процессах, особенно лёгких атомов Н, С, О, N, S и др. Этим методом часто удаётся установить способ и условия разделения химических элементов и образования конкретных минералов и рудных залежей Геохимические процессы разделения элементов на Земле поддерживаются прежде всего теплом, генерируемым радиоактивными элементами (радиогенное тепло), гравитационной энергией. На поверхности Земли значительную роль играет энергия солнечных лучей, которая, в частности, трансформируется живым веществом в химическую энергию нефтей и углей. Геохимические процессы. Первичное разделение холодного недифференцированного вещества Земли на оболочки произошло под влиянием тепла адиабатического сжатия планеты и радиогенного тепла. В мантии Земли на различных глубинах, особенно в астеносфере, возникали многочисленные расплавленные очаги. Разделение на оболочки шло путём зонного плавления, которое не требует полного расплавления мантии. Силикатное вещество планеты разделялось на тугоплавкую фазу — ультраосновные породы верхней мантии, и легкоплавкую фазу — основные породы (базальты) земной коры. Легкоплавкое вещество проплавляло кровлю магматической камеры, а тугоплавкое кристаллизовалось на дне камеры; т. о. легкоплавкое вещество перемещалось вверх к поверхности Земли. При этом метасиликаты инконгруентно разлагались на ортосиликаты и кремнекислоту, обогащенную химическими элементами, понижающими температуру плавления: щелочными элементами, Si, Ca, Al, U, Th, Sr и др. редкими литофильными элементами. Вещества, повышающие температуру плавления (Mg. Fe, Ni, Co, Cr и др.), сохранились по преимуществу в тугоплавкой фазе, т. е. остались в мантии Земли. Вместе с зонным плавлением шёл процесс дегазации верхней мантии. Процессы выплавления и дегазации вещества мантии имеют периодический характер. После того как произошёл вынос тепла и вещества из глубин на поверхность Земли, требовалось время на новое разогревание очага. С таким геохимическим циклом связан весь ритм тектоно-магматической и вулканической деятельности и метаморфических преобразований. Этот процесс шёл также на Луне и, по-видимому, на всех планетах земного типа. Химическая эволюция Земли поддерживается и регулируется непрерывным процессом выплавления и дегазации вещества мантии за счёт энергии радиоактивного распада. Вещество мантии Земли (перидотиты, дуниты и др. ультраосновные породы) имеет химический состав, приближающийся к метеоритному (табл. 4).
Табл. 4 — Химический состав горных пород Земли, Луны и метеоритов
Господствующие в мантии высокие температуры и давления приводят к полиморфным изменениям минералов, например к образованию стишовита, т. е. кварца с плотностью 4350 кг/м3 (при нормальном давлении и температуре), и т. п. Благодаря этому вещество мантии разделяется на зоны с разной плотностью. Вещество верхней мантии проникает к поверхности на материках в дунитовых поясах, богатых хромитами, платиноидами, высокотемпературными сульфидами, в океанах — в рифтовых долинах срединноокеанических хребтов. Ранее, ссылаясь на наличие сульфидных руд в земной коре, геологи допускали существование в мантии сульфидной оболочки. Однако определение изотопного состава свинца из разных сульфидных руд показало их различный абсолютный возраст; следовательно, отторжение сульфидов из горных пород происходило в разное время, так что гипотеза сульфидной оболочки лишена достаточного основания. Процесс образования металлического сплава Fe — Ni, из которого состоит ядро Земли, наименее изучен. Вероятно, ядро формировалось в процессах агломерации в протопланетном облаке и далее при адиабатическом сжатии Земли, что продолжалось длительное время. Над мантией располагается земная кора, которая отделяется от вещества мантии границей Мохоровичича (см. Мохоровичича поверхность). Выделяют два типа земной коры: материковую (континентальную) и океаническую. Мощность континентальной коры достигает в среднем 35—40 км, а океанической — 6—8 км. Примитивные (толеитовые) базальты океанической коры — более сложная система, чем вещество каменных метеоритов; они состоят по крайней мере из 4 главных компонентов: MgO, SiO2, FeO, Al2O3. В них отношение Si/Mg = 6,5, т. е. они не солнечного состава. Базальты земной коры, лунные породы (с поверхности лунных «морей») и эвкриты (базальтические каменные метеориты) имеют идентичный состав и одинаковую офитовую структуру. Исключительную роль в силикатных и др. системах играют вода и др. летучие, понижающие точку плавления системы. Наиболее существенное влияние на магматические процессы оказывает вода в состоянии, близком к надкритическому. В мантии под вулканами методами сейсмологии обнаружены камеры, заполненные жидкой магмой. Излияние базальтов сопровождается выделением водяного пара — около 7% по массе (20% по объёму) от излившегося базальта — и кислых дымов и газов NH (CO2, HF, HCl, S, SO2). В высокотемпературной стадии остывания базальта (600—800°С) выделяются главным образом CO2, HF, HCl. При средних температурах (около 200°С) также и соединения серы. При низких температурах и в поствулканической (фумарольной) стадии выделяются CH4, 4Cl, Н3ВО3, CO2 и др. газы, а также минерализованные растворы. Образование CO2, СО, CH4 — результат реакции в магме углерода с H2O при разных температурах и давлениях. Этот процесс сопровождается частичным разделением изотопов углерода — утяжелением углерода (повышением содержания С13) в CO2, алмазах и карбонатитах (CaCO3 кимберлитовых трубок) по сравнению с углеродом др. горных пород. Базальтовая лава при охлаждении подвергается фракционной кристаллизации с образованием различных магматических пород, имеющих общие признаки. В магматической стадии дифференциации возможны ликвация (например, отделение от силикатов высокотемпературных Cu — Ni — Fe сульфидов) и газовый перенос. В ранней стадии фракционной кристаллизации магмы могут образоваться магнетит и титаномагнетит, как следствие окисления в магме Fe2+ ® Fe3+; магнетит не растворяется в силикатном расплаве и увлекает с собой Ti в силу близости Ri Fe3+ (0,65) и Ti4+ (0,60). В стадии главной кристаллизации образуются плагиоклазы от Лабрадора до олигоклаза и многие др. алюмосиликаты. По мере остывания происходит накопление в расплаве более легкоплавких и летучих соединений, на известной стадии вступающих в реакцию с ранее выделившимися более высокотемпературными соединениями (реакционный принцип Боуэна). В этом отборочном механизме в остаточном расплаве концентрируются ионы, которые не вошли в породообразующие минералы из-за своих больших или очень малых Ri. С этими остаточными расплавами связывают происхождение богатых редкими элементами пегматитов и др. горных пород. Кислые горные породы — граниты, граподиориты и другие — имеют большое распространение в земной коре. Одни из них содержат много Ca (около 2,5%) и тяжёлых металлов, мало щелочей и летучих, другие бедны Ca (около 0,5%) и тяжёлыми металлами, но богаты щелочами и летучими. Происхождение гранитов большинство учёных связывает с эвтектическим плавлением, с процессом гранитизации (метаморфизм и метасоматизм) осадочных горных пород на различных уровнях земной коры. Повышенное содержание 18О в кварце гранитов отвечает относительно низким температурам образования минерала. В земной коре материков образуются рудные залежи — месторождения многих химических элементов, прежде всего Fe, Cu, Ni, Со, Pb, Zn, Mo, Ag, Hg, в виде окислов, сульфидов и др. Их происхождение связано с гидротермальными растворами (см. Гидротермальные месторождения), несущими также и газы. Несмотря на известное разнообразие их состава в связи с глубиной, температурой и др. условиями образования, они имеют общие черты, например обычны ассоциации SiO2 — Au или Pb — Zn — Cu и др. в виде сульфидов или ассоциации SnO2 — WO3 — H3BO3 — F в гидротермальных и грейзеновых месторождениях. Гидротермальные образования и грейзены рассматриваются как конечные продукты тектоно-магматического процесса или гранитизации. Источниками рудного вещества гидротерм могут быть как подкоровые процессы, так и процессы в земной коре. Вопрос о способе переноса тяжёлых металлов вызывает споры. Не исключается газовый перенос металлов, например в виде фторидов, причём фтор часто даёт во вмещающих породах большие ореолы рассеяния. Неясны равновесия фторидов, хлоридов, металлов с H2O при разных температурах и давлениях. О химических и физических условиях рудообразования даёт представление состав газово-жидких включений в рудных минералах, которые содержат растворы NaCI, MgCl2, MgSO4, KCl, H2S, SiO2, карбонатов и следы металлов; нередко высокое давление CO2 — до 2000 атм. Эти растворы близки к нейтральным; температура их образования лежит в пределах 50—550 °С. Обыкновенные сульфиды тяжёлых металлов Pb, Zn, Cu, Fe и многие др. мало растворимы в воде, и изменение давления и температуры почти не меняет их растворимости. Например, чтобы осадить 1 т цинка из раствора ZnS, нужно было бы испарить около 10 км3 воды. Маловероятен перенос сульфидов и в виде коллоидных растворов — золей. Существуют, однако, комплексные соединения сульфидов тяжёлых металлов, более растворимые, чем простые сульфиды, например дающие ионы HZnS22— или HgS2—. Большую роль в процессе переноса тяжёлых металлов горячими растворами играет концентрация в них CO2 и, вероятно, др. газов: O2, H2S, PH3. Например, U образует комплексы [UO2(CO3)3]4—, легко растворимые в H2O при определённой концентрации CO2. Уменьшение CO2 в растворе разрушает этот комплекс и вызывает отложение соединений U. Отложение тяжёлых металлов регулируется также парциальным давлением H2S, которое определяет последовательность отложения металлов в сульфидном теле, парциальным давлением CO2, окислительным потенциалом и т. д. Кристаллизация сульфидов, например Pb, Zn и мн. др., распределение в них редких элементов In, Ga, Ge, Tl и т. д. происходит по законам изоморфизма. Процесс отложения сульфидов отражается на изотопном отношении S32/S34 в минералах, что имеет диагностическое значение. Магматические породы на поверхности Земли разрушаются под влиянием климатических факторов и ряда других агентов: организмов, воды, углекислоты, органических веществ; этот процесс зависит от концентрации ионов водорода и кислорода, ионного потенциала и др. условий. Вещество горных пород при выветривании испытывает сложные превращения. Например, полевые шпаты превращаются в каолинит, карбонаты и кварц; Na, Mg, К в виде хлоридов, сульфатов, карбонатов переходят в раствор и уносятся потоками в океан и т. д. Вследствие гидратации и карбонатизации общий объём пород увеличивается (рис. 2). В разрушении горных пород участвуют многие химические процессы, как, например, гидролиз алюмосиликатов, который приводит к образованию латерита, свободных водных окисей Al2O3 и бокситов, которые обогащены Ti, Nb, Sn, Be и др. Окисление до более высоких валентностей часто выполняется микроорганизмами, например Fe2+®Fe3+, Mn2+®Mn4+ и т. д. Железные осадочные руды обогащаются фосфатами, арсенатами, ванадатами, а марганцевые — Ba, Ra, Со и др. Известняки, а также доломиты, фосфаты и некоторые др. соли образуются при участии организмов и накапливают Sr, Mn, Pb, F, редкоземельные элементы и т. д. Соленосные отложения возникают в результате испарения воды в изолированных бассейнах. Последовательность отложения солей NaCl, MgSO4 и др. идёт по законам галогенеза. В этом процессе происходит отделение твёрдых солей от насыщенного раствора — рапы, которая содержит наиболее растворимые соли Na, К, Sr, Li, В, Br. Подобные растворы встречаются и в подземных высокоминерализованных водах. Органическое вещество суши при захоронении приводит к образованию углей, а органическое вещество донных отложений современных и древних морей (главным образом планктона) — к образованию нефтей и горючих газов. Изотопный анализ отдельных фракций нефтей на 12С/13С указывает температуру их образования — не свыше 200—250°С. Появление углей и нефтей в земной коре изменило миграцию и распределение ряда осадочных элементов. Так, например, U, V, Ge обычно концентрируются в осадочных железных рудах. С появлением углей их соединения стали накапливаться и в углях и в битумах, образуя нередко месторождения этих элементов. Наиболее стойкие минералы — монацит, торит, золото, магнетит, кварц, циркон, рутил, касситерит и др., при разрушении горных пород накапливаются в прибрежной части морей и океанов и образуют в зонах морского шельфа россыпные месторождения. Мощность осадочных пород на материках в некоторых местах достигает 20 км, а в среднем превосходит 1 км. Общее количество осадочных пород на земном шаре указано в табл. 5.
Табл. 5. — Количество пород на земном шаре
Главную массу пород составляют глины и сланцы (около 55%), карбонатные породы (около 25%), пески и песчаники (около 20%). Все магматические и осадочные горные породы подвергаются в той или иной степени метаморфизму. Разнообразные процессы в твёрдом веществе горных пород идут либо без выноса и привноса вещества извне (собственно метаморфизм), либо с выносом и привносом вещества (метасоматизм). Различают щелочной метасоматизм (натриевый или калиевый), магнезиальный, кальциевый, железистый, а также серный (березитизация гранитов), фосфатный, боратный и др. Глины превращаются в сланцы, известняки в мраморы и т. п. На глубине под действием высокой температуры породы могут испытать переплавление (палингенезис, гранитизацию). Все превращения, связанные с метаморфизмом, направлены к химическому равновесию, перекристаллизации с уменьшением объёма. Образуются минералы с большей плотностью и породы более или менее однообразного минерального состава, содержащие кварц, полевой шпат, слюды (системы с минимумом свободной энергии). В силу сложности и разнообразия процессов метаморфизма за основу классификации метаморфических пород берутся их минеральные ассоциации (минеральные фации), как показатели условий образования этих пород. Региональная неравномерность распределения отдельных химических элементов заставляет выделять на Земле различные геохимические провинции. Изучение территориального распространения химических элементов в связи с геологией района составляет задачу региональной геохимии, конечной целью которой является составление геохимических карт территории на базе общих геологических данных. Геохимические процессы в гидросфере, атмосфере и биосфере. Водная оболочка Земли — гидросфера — возникла в результате излияния базальтов и выноса в этом процессе воды, СО2 и др. газов. Мировой океан со средиземными и приконтинентальными морями занимает около 71% поверхности Земли и имеет общий объём 1,37·1018 м3. Строение дна океанов — результат грандиозных магматогенных процессов. Донные осадки составляют около 1,2·1021 кг. Легкорастворимые вещества обогащают водный раствор, труднорастворимые накапливаются в осадках дна. Соотношения растворённых солей сохраняются постоянными. Главные ионы океанической воды указаны в табл. 6.
Табл. 6. — Главные ионы океанической воды (на 1 кг океанической воды при солёности S=35,00°/oo и хлорности С1=19,375 °/оо)
* В настоящее время содержание Sr в океанической воде принимается равным 8·10—4%.
В толще воды устанавливаются сложные равновесия между органическим веществом, солями, газами и др. веществами океанического раствора и химическим составом донных отложений. Все воды материков (представляющие собой производные океанической воды) составляют 3% массы воды океана. В воде рек и пресных озёр главными ионами являются (в порядке убывания содержания) Ca2+, Na+, Mg2+, СО32—, SO42—, Cl—. С поверхности океанов ежегодно испаряется около 500 тыс. км3 воды, которая частично сбрасывается на материки, просачивается через слои осадочных пород и образует подземные воды. Захороненные воды бывших морских илов образуют межпластовые воды. Под влиянием обмена между межпластовыми водами и породами и в зависимости от температуры пластов формируется состав подземных вод. Известны подземные воды нефтеносных областей, богатые I и Br, иногда В; хлоркальциевые воды (например, в девонских слоях Восточно-Европейской платформы); бессульфатные, богатые Ra; сероводородные, обычно возникающие в результате восстановления SO42— бактериями; богатые Li (в Иркутском амфитеатре) и др. Разнообразны и воды минеральных источников. В областях древнего вулканизма минеральные источники — холодные, без CO2. В областях недавнего вулканизма появляются горячие источники с разнообразным солевым составом. Разработана их классификация. Древняя газовая оболочка Земли была маломощной и состояла из CO2, H2O, возможно CH4 и др. газов. Современная атмосфера возникла вторично, с появлением на Земле свободного кислорода в результате фотосинтетической деятельности растений. После этого продукты вулканической эксгаляций S, H2S, NH3, H2, CH4 и др. были окислены, выбыли из атмосферы и осталась современная азотно-кислородная оболочка Земли (см. Атмосфера). Из пород Земли в атмосферу при действии вулканов выделяются лёгкие газы He4, He3, Н, D («гелиевое дыхание»), которые не удерживаются гравитационным полем Земли и диссипируют (рассеиваются) в космическое пространство. Источником CO2 (а также следов HF, HCl и др.) являются тоже вулканы. На содержание в атмосфере CO2 оказывает влияние океан, поглощающий CO2 в холодных широтах и освобождающий CO2 на экваторе. Поэтому на экваторе парциальное давление CO2 в атмосфере несколько выше. Изотоп аргона 40Ar накапливается в атмосфере в результате ядерного превращения 40K ® 40Ar (К-захват). Др. инертные газы — Ne, Kr, Xe — первичного происхождения. Атмосфера играет огромную роль в качестве транспортёра многих легколетучих соединений, галогенидов, органических веществ и т. п. Газы атмосферы участвуют в геохимическом выветривании горных пород, например O2, CO2. Азот фиксируется синезелёными водорослями и некоторыми др. растениями. После их гибели в результате метаморфизма их остатков образуется калийная селитра. Подземные атмосферы, заполняющие пористые породы, имеют разнообразный состав и образуются различными путями. Атмосферные газы могут быть захвачены осадочными породами. В этом случае для них характерно содержание 40Ar по отношению к N2 около 1%. Азотные струи без 40Ar — результат метаморфизма органического вещества (биогенные газы). Известны подземные атмосферы из CO2, а также струи CO в районах вулканической деятельности, нефтяные газы CH4, C2H6, C3H8 и др. углеводороды в нефтеносных областях, сероводород, радиогенные газы — Не, Rn и др. Биосфера — область на границе твёрдой, жидкой и газовой оболочек Земли, занятая живым веществом — совокупностью организмов. Биосфера возникла около 3,5.109 лет тому назад. Благодаря маломощной первичной атмосфере космическое излучение проникало на Землю. Под влиянием этого облучения из вулканических дымов и газов H2O, СО, CO2, HF, HC1, CH4, S, H2S, S2, NH3, H3BO3 и др. происходил абиогенный синтез многих сложных соединений углерода с симметричными молекулами, оптически неактивными. На этом фоне возник биогенный синтез асимметричных оптически активных молекул живого вещества. После возникновения в результате фотосинтеза азотно-кислородной атмосферы над ней образовался озоновый экран. Вследствие этого космические лучи практически перестали проникать к поверхности Земли и абиогенный синтез органических соединений прекратился. Организмы не только изменили состав атмосферы, но прямо или косвенно участвуют в многочисленных геохимических процессах (см. Биогеохимия). История отдельных элементов в земной коре. Г. отдельных элементов, поведение их в разных природных процессах составляют специальную часть общей Г. и часто представляют значительный экономический интерес. Закономерные парагенезисы (ассоциации элементов) встречаются в разных природных процессах, но затем может происходить и разделение элементов. Например, все галогениды в виде HF, HCl, HBr, HI поступают на поверхность Земли с вулканическими эманациями. В дальнейшем соединения I— под влиянием окислительно-восстановительных реакций (и солнечной радиации) легче других галогенидов окисляются, т. е. переходят в I2, который транспортируется через атмосферу и на поверхности Земли совершает свой круговорот (рис. 3). HF вулканических газов немедленно фиксируется материковыми породами, особенно молекулой P2O5, образуя прочную молекулу, лежащую в основе фторапатита. Соли HCl и HBr переходят в водные растворы и мигрируют вместе. Разделительным процессом для них является главным образом процесс садки солей при испарении растворов в изолированных бассейнах. NaCl поступает в осадок, а соли Br остаются в рапе озёр. Отношение Cl/Br в океане близко к 300, то же примерно в озёрах, реках и т. д. Но в отложениях галита отношение C1/Br около 10000 и больше, а в рапе (или в Мёртвом море) около 50. Т. о., по этому отношению Cl/Br можно устанавливать происхождение минеральных растворов. Другой пример: S, Se, Те выбрасываются вулканами. В гидротермальных рудных отложениях и сульфидах тяжёлых металлов они находятся вместе, но на поверхности Земли разделяются: S легко окисляется в SO42— и сбрасывается в море; при испарении морской воды образуются осадки сернокислого кальция — гипсы, ангидриты. Se трудно окисляется и в виде нерастворимых водных солей (Fe и др.) селенистой кислоты образует скопления. Те рассеивается при окислении. Миграция Са, Sr, Ba, Ra имеет много общих этапов. Однако Ba, встречаясь с SO42—, даёт нерастворимые соединения BaSO4. Одновременно тут же накапливается и RaSO4. Бикарбонаты Ca и Sr сбрасываются в виде водных растворов в океаны. При этом, в силу большой растворимости солей Sr2+, он не уходит в карбонатные осадки, а накапливается в растворах. Ещё более сложные разделительные процессы идут при образовании сульфидных гидротермальных отложений и во многих др. случаях. Миграция отдельных элементов из одной термодинамической системы в другую является частью общего круговорота или цикла миграции вещества на Земле. Связь геохимии с другими науками. Исторический очерк. Г. стоит на стыке геологических, физических и химических наук и через биогеохимию связывается с биологических науками. Наиболее тесно Г. связана с геологическими науками — минералогией и петрографией, особенно в вопросах генезиса минералов, горных пород и геологических процессов. Регионально-геохимические исследования проводятся в тесном сочетании с геотектоническими построениями. В Г. применяются современные физические и химические методы исследования вещества и процессов в широком диапазоне температур и давлений — спектральные, масс-спектральные, резонансные, ядерные и др.; используются математические методы. Изучение поведения вещества при высоких температурах и давлениях связывает Г. с геофизикой. Оценка абсолютного времени, которая лежит в основе исторической геологии, и ряд др. проблем истории Земли решаются только точными методами геохимических и радиохимических исследований (см. Геохронология). В палеонтологии при решении вопросов образования твёрдых скелетных частей организмов и их эволюции важно знать геохимические условия, в которых жили организмы. Изучение ископаемого органического вещества раскрывает процессы образования каустобиолитов. Геохимические идеи играют очень большую роль в развитии почвоведения; они направлены на решение ряда важных вопросов агрохимии и агрономии. Геохимическое изучение почвенного покрова очень важно для геохимических поисков полезных ископаемых. В географии также развивается геохимическое направление — геохимия ландшафта. Изучение геохимических процессов, связанных с флорой и фауной, имеет большое значение для сельского хозяйства и медицины (см. Биогеохимия). Идеи Г. проникают в астрофизику, атомную физику, химию и физическую химию, химическую технологию и металлургию (особенно редких металлов). Г. успешно разрабатывает и внедряет в практику геохимические поиски месторождений полезных ископаемых и содействует решению проблемы комплексного использования минерального сырья. Она активно участвует в той огромной работе, которая проводится в Советском Союзе в области химизации народного хозяйства и особенно химизации сельского хозяйства. Г. возникла на основе учения об атомах. Корни её уходят в прошлое геологоминералогического знания. Геохимические идеи появились уже в конце 18 в. Немецкий геолог К. Г. Бишоф, французский геолог Л. Эли де Бомон и др. накапливали геохимические факты, касавшиеся состава, миграции вещества в водных растворах, а также в магматических вулканических процессах. Шведский химик и минералог И. Я. Берцелиус в 1-й половине 19 в. изучал химический состав большого числа минералов и первым предложил химическую классификацию минералов. Химический анализ минералов и горных пород, исследования химическую состава природных газов и вод, химическое изучение полезных ископаемых привели в середине 19 в. к возможности заложить основы Г. В 1838 швейцарский химик К. Ф. Шёнбейн впервые ввёл термин «Г.". Многочисленные сведения по Г. были получены к концу 19 и началу 20 вв. Первую обширную сводку данных по Г. дал (1882) американский геохимик Ф. У. Кларк. Формулирование основных задач в Г. принадлежит советским академикам В. И. Вернадскому, А. Е. Ферсману и норвежскому геохимику В. М. Гольдшмидту. Значит, вклад в Г. был сделан работами Н. С. Курнакова и его школы, заложившими основы Г. галогенеза, а также физико-химического анализа природных солевых систем. Идеи Вернадского и Ферсмана нашли особенно благоприятную почву для развития после Великой Октябрьской социалистической революции. В СССР ученики В. И. Вернадского и А. Е. Ферсмана — А. П. Виноградов, Д. И. Щербаков, П. Н. Чирвинский, Н. В. Белов, А. Г. Бетехтин, Н. М. Страхов, В. С. Соболев, К. А. Ненадкевич, В. Г. Хлопин, А. А. Сауков, К. А. Власов, В. В. Щербина, В. И. Герасимовский, Н. И. Хитаров и мн. др. разрабатывали и разрабатывают как общие, так и отдельные вопросы Г. Во 2-й половине 20 в. усилились исследования по радиоактивности горных пород и минералов, развивалась изотопная Г., широко развернулись работы по определению абсолютного возраста пород. Геохимические исследования в СССР ведутся не только в научно-исследовательских институтах, но и в очень многих производственных организациях. Г. преподаётся в университетах и др. учебных заведениях. Был создан ряд геохимических институтов и отделов, в том числе биогеохимическая лаборатория, реорганизованная позже в институт геохимии и аналитической химии им. В. И. Вернадского (см. Геохимии и аналитической химии институт). В 1956 начал издаваться журнал «Геохимия».
Лит.: Вернадский В. И., Очерки геохимии, 4 изд., М. — Л., 1934; Ферсман А. Е., Геохимия, т. 1—4, Л., 1933—1939; его же, Пегматиты, 3 изд., т. 1, М. — Л., 1940; Виноградов А. П., Геохимия редких и рассеянных химических элементов в почвах, 2 изд., М., 1957; его же, Введение в геохимию океана, М., 1967; его же, Предварительные данные о лунном грунте, доставленном автоматической станцией «Луна-16», «Геохимия», 1971, № 3; Vinogradov A. P., The elementary chemical composition of marine organisms, New Haven, 1953; Сауков А. А., Геохимия, [3 изд.], М., 1966; Clarke F. W., The data of geochemistry, 5 ed., Wash., 1924; Goldschmidt V. M., Geochemistry, Oxf., 1954; Rankama K., Progress in isotope geology, N. Y. — L., 1963; Krauskopf K. B., Introduction to geochemistry, N. Y. — L., 1967; Handbook of geochemistry, ed. K. Н. Wedepohl, v. 1—2, В. — [а. о.], 1969; Mason Br., Principles of geochemistry, 3 ed., N. Y. — L. — Sydney, 1970; Slater J C., Atomic radii in cryetals, «Journal of chemical Physics», 1964, v. 41, № 10, p. 3199—3204; Ahrens L. Н., The use of ionization potentials. pt. I — Ionic radii of the elements, «Geochimica et cosmochimica Acta», 1952, v. 2, № 3. А. П. Виноградов.
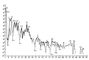 Рис. 1. Распространённость химических элементов на Солнце 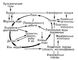 Рис. 3. Круговорот иода  Рис. 2. Увеличение объёма породы в зоне выветривания.  Табл. 2. Величины атомных и ионных радиусов (в |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||