Большая Советская Энциклопедия
(БСЭ)
|
|
|
|
источник статьи: Большая Советская Энциклопедия (БСЭ) |
|
Водородный электрод, платиновая пластинка, электролитически покрытая платиновой чернью, погружённая в раствор кислоты с определённой концентрацией ионов водорода Н+ и омываемая током газообразного водорода. Потенциал В. э. возникает за счёт обратимо протекающей реакции Между водородом, адсорбированным платиновой чернью, и ионами водорода в растворе устанавливается равновесие. Потенциал электрода Е определяется уравнением Нернста: где Т — абсолютная температура (К), аН+ — активная концентрация ионов водорода (г-ион/л), р — давление водорода [кгс/см2 (атм)], Е° — нормальный (или стандартный) потенциал В. э. при р = 1 кгс/см2 (1 атм) и aH+ = 1. При любой заданной температуре Е° условно принято считать равным нулю. От потенциала стандартного В. э. отсчитывают потенциалы всех других электродов (так называемая водородная шкала потенциалов). При работе с В. э. необходима тщательная очистка водорода от примесей. Особенно опасны соединения серы и мышьяка, а также кислород, реагирующий с водородом на поверхности платины с образованием воды, что приводит к нарушению равновесия В. э. применяют как электрод сравнения. 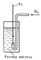 Рисунок к ст. Водородный электрод. |